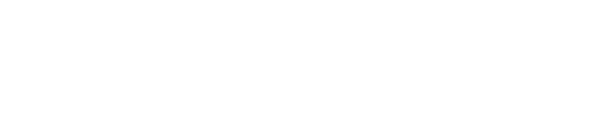抗体药物偶联物(ADC)是癌症治疗中最为先进的药物之一,取得了令人瞩目的研究进展。然而,它们通常面临着药物含量低(药物/抗体比DAR:约3-4)、抗体用量大等问题,导致高昂的制备和治疗成本。靶向纳米药物可有效提高药物含量,可望替代ADC用于癌症治疗,但目前仍存在载体稳定性差、药物过早泄漏及肿瘤特异选择性低等缺点。
近日,苏州大学放射医学与辐射防护国家重点实验室钟志远教授团队设计构建了基于anti-CD44抗体修饰的囊泡-美登素偶联物的细胞选择性纳米毒素(aCD44-AP-DM1),以实现实体瘤的高效治疗(图1)。相关成果以“Anti-CD44 antibody-polymersome-DM1 nanoconjugates: an intelligent cell-selective nanotoxin toward triple negative breast cancer”为题于2021年11月12日发表在Journal of Controlled Release(2021,340,331-341)上,论文链接:(https://www.sciencedirect.com/science/article/pii/S016836592100609X)。
其中DM1在囊泡形成的过程中通过双硫键键合在疏水膜上,anti-CD44抗体通过张力触动的点击化学反应修饰在囊泡表面,所得aCD44-AP-DM1表面的单抗密度可调(1.1-9.8个),DAR高达138-1307,可有效避免药物泄漏,而在肿瘤部位可还原响应快速释放药物。研究表明,aCD44-AP-DM1在CD44阳性MDA-MB-231 三阴性乳腺癌细胞、SMMC-7721细胞和A549肺癌细胞中均具有显著的抗肿瘤活性,以aCD445.0-AP-DM1最佳,其 IC50值分别为21.4、3.7和64.6 ng/mL,相比非靶向P-DM1组降低了3.6-47.2倍。
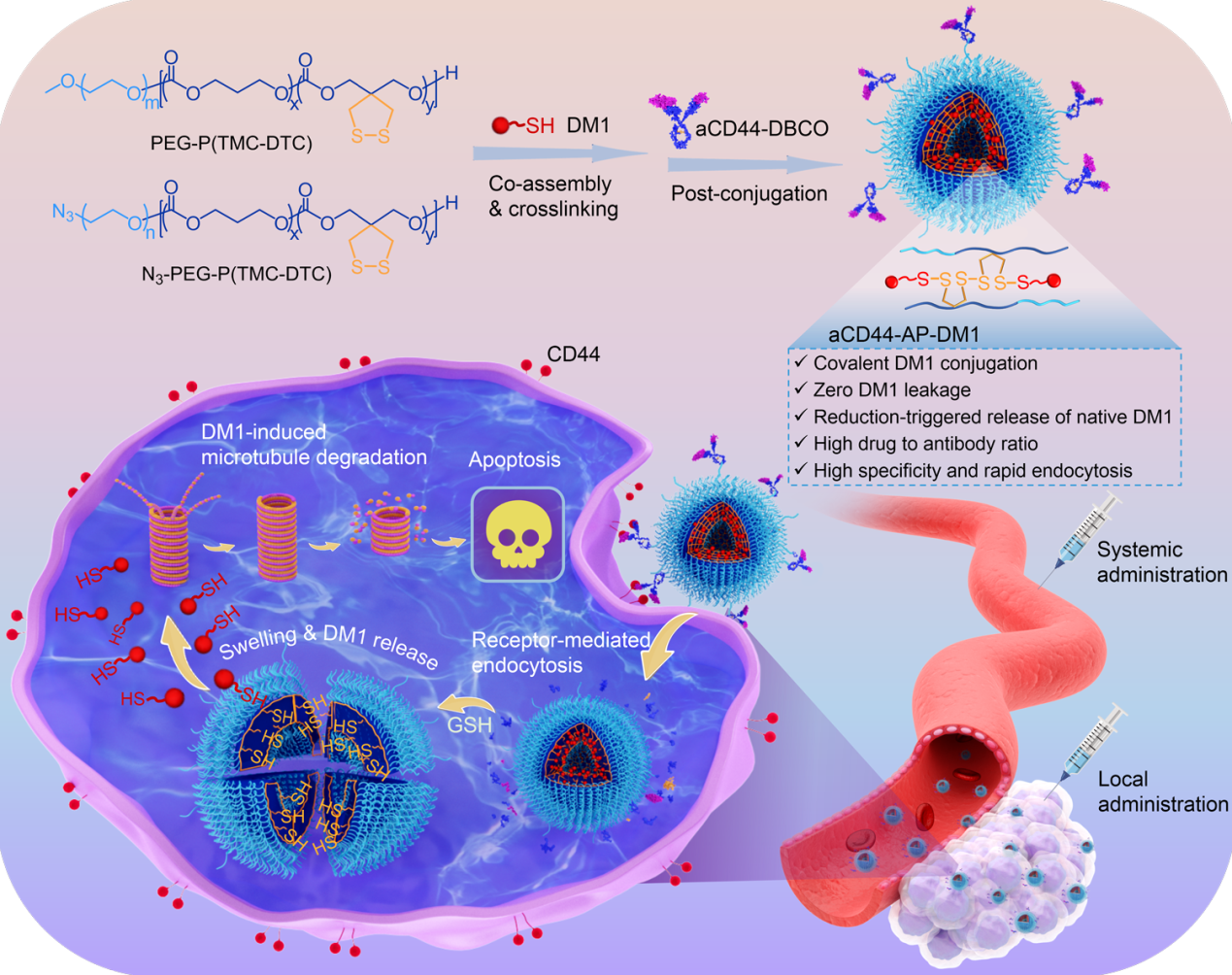
图1. 基于anti-CD44-囊泡-美登素(aCD44-AP-DM1)偶联物的细胞选择性纳米毒素靶向治疗三阴性乳腺癌。
在荷皮下MDA-MB-231三阴性乳腺癌小鼠模型中,尾静脉注射aCD44-AP-DM1(0.4 mg DM1 equiv./kg)4次后,可显著抑制肿瘤生长,同时具有较好的安全性。而通过瘤内注射给药2次后,肿瘤抑制率高达99.8%,其中在0.2和0.4 mg DM1 equiv./kg剂量下,80%小鼠获得完全治愈且无复发(图2)。重要的是,aCD44-AP-DM1的生物安全性较好,小鼠体重无明显下降,正常器官未见明显损伤,其血常规及血生化指标与健康小鼠水平相当。
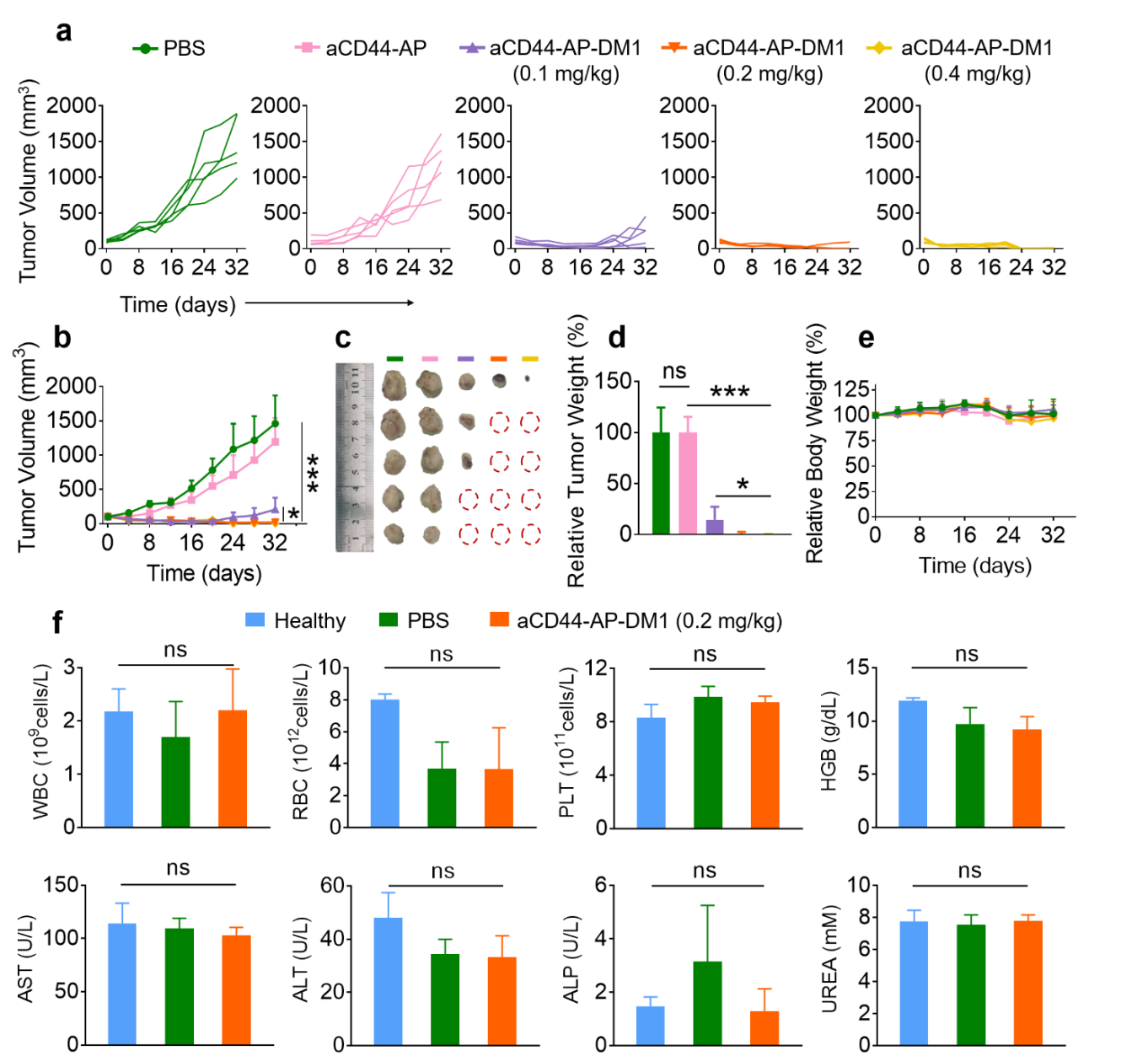
图2. 瘤内注射aCD44-AP-DM1治疗皮下MDA-MB-231三阴性乳腺癌小鼠模型的效果。
该工作作为免疫纳米体系用于强效毒素DM1特异性靶向递送的首篇报道,有望提供一个高稳定性平台,用于修饰不同的抗体,为多种肿瘤的高效靶向治疗提供新策略。苏州大学为该论文第一单位,博士研究生张翼帆和岳淑静为共同第一作者,孙欢利副教授和钟志远教授为通讯作者。该工作得到了国家自然科学基金(51633005, 52073196, 51761135117)和德国科学基金等的共同资助。